Un estudio internacional liderado por la Universidad de Granada demuestra que dos genes con funciones muy importantes durante el desarrollo embrionario del testículo, denominados Sox8 y Sox9, son los responsables de que se mantenga el testículo en el animal adulto y, si se eliminan, provocan que algunas de sus células cambien de masculinas (testiculares) a femeninas (ováricas).
Un equipo internacional de científicos, liderado por la Universidad de Granada, han dado un importante paso en la investigación sobre la “reprogramación genética” del sexo, que aunque aún es una utopía, está cada vez más cerca.
En un estudio realizado en ratones, los investigadores han descubierto que dos genes con funciones muy importantes durante el desarrollo embrionario del testículo, denominados Sox8 y Sox9, son los responsables de que se mantenga el testículo en el animal adulto.
Si se eliminan, provocan la desaparición de los tubos seminíferos (encargados de producir los espermatozoides), y que ciertas células cambien de masculinas (testiculares) a femeninas (ováricas), un hecho que nunca antes se había comprobado en adultos, y que es una evidencia clara de “reprogramación” genética del sexo.
Esta investigación, que han coordinado el Centro de Investigación Biomédica y el departamento de Genética de la Universidad de Granada, se publica en la revista eLife, y en ella participan las universidades de Friburgo (Alemania), California-San Diego (Estados Unidos), British Columbia (Canadá) e Instituto de Genética Molecular Max Planck (Alemania).
Como explican los investigadores de la UGR Francisco Barrionuevo, Miguel Burgos y Rafael Jiménez, “durante muchos años se había creído que las gónadas adultas, testículos y ovarios, eran órganos estables e inmutables, desarrollados de forma definitiva e incapaces ya de modificar su estructura y función”.
Sin embargo, en 2009 se demostró que un gen clave llamado Foxl2 debe mantenerse activo permanentemente en el ovario adulto para impedir que determinadas células específicas de este órgano, las células de la granulosa, adquieran las características genéticas de las células de Sertoli, que son propias del testículo.
“De manera similar, Dmrt1, un gen que normalmente se encuentra activo en las células de Sertoli, juega un papel similar en el testículo infantil, impidiendo la transformación celular en sentido contrario. Por tanto, ha surgido un nuevo concepto biológico, el mantenimiento del sexo, por el que ciertos genes se encargan de evitar que las gónadas experimenten un proceso de “reprogramación” genética del sexo. Sin embargo, el mecanismo del mantenimiento del testículo adulto permanecía desconocido hasta ahora”, señalan los científicos de la UGR.
Reprogramación genética de macho a hembra
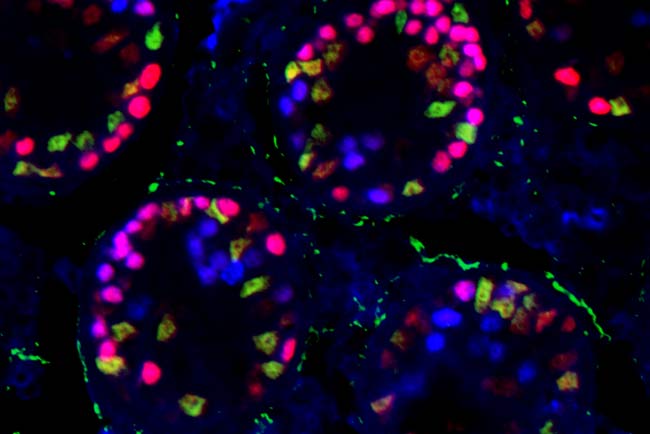
En este trabajo, los científicos han inducido la inactivación del gen Sox9 en las células de Sertoli de los testículos de ratones adultos que ya eran mutantes para el gen Sox8, y han estudiado los cambios experimentados en los testículos de estos dobles mutantes a partir de entonces.
Observaron que estas células de Sertoli “sufren una reprogramación genética de macho a hembra, pasando a expresar numerosos genes propios de las células de la granulosa, incluido Foxl2, y que posteriormente acababan muriendo mediante un proceso de suicidio programado denominado apoptosis”.
El proceso culmina con la degeneración completa de los túbulos seminíferos del testículo (donde se encuentran las células de Sertoli y las células germinales), que se convierten en huecos vacios. Sólo persisten las células de Leydig, que se encuentran por fuera de los túbulos seminíferos y producen la testosterona.
“En conclusión, nuestro estudio ha demostrado que, además de su papel crucial en el desarrollo testicular, el gen Sox9, junto con Sox8 y coordinadamente con Dmrt1, también controla el mantenimiento del testículo adulto. Si se eliminan, el testículo desaparece y pasa a tener un perfil de expresión génica propio del ovario, lo que equivale a decir que se convierte en un órgano genéticamente similar a un ovario.
Francisco Barrionuevo y Rafael Jiménez apuntan que, aunque este estudio se ha realizado en ratones, “se esperaría que en humanos ocurriera lo mismo, si bien es muy pronto para afirmar que podemos cambiar el sexo de las personas silenciando estos genes, lo que a día de hoy es ciencia ficción”.
Sin embargo, la investigación futura tratará de dilucidar cuál es la relación funcional entre Sox8/Sox9 y Dmrt1 en las células de Sertoli adultas, lo que contribuirá a conocer la base científica de la función testicular, permitiendo así el desarrollo de terapias contra la infertilidad masculina y la reversión sexual”.
















