Mantener estables los niveles de estrés oxidativo es fundamental para la salud celular, si bien este equilibrio está habitualmente desregulado en células tumorales. Este desequilibro, hace que las células tumorales sean más sensibles a cambios externos que puedan aumentar el estrés de manera que sea incompatible con la supervivencia celular. Por este motivo, numerosas investigaciones exploran terapias inductoras de estrés oxidativo como tratamiento del cáncer, y el campo de la nanomedicina ofrece prometedores avances.
Un nuevo trabajo de investigadores del Consejo Superior de Investigaciones Científicas (CSIC), que se publica en la revista Biomaterials, identifica recubrimientos de nanopartículas de óxido de hierro que afectan específicamente al crecimiento de las células tumorales al generar elevados niveles de estrés oxidativo que terminan afectando su metabolismo mitocondrial, lo que abre la posibilidad de su uso combinado en terapias ya establecidas.
Por qué las nanopartículas de óxido de hierro son prometedoras contra el cáncer
Las nanopartículas de óxido de hierro son una novedosa herramienta en biomedicina: su pequeño tamaño y la capacidad de nuestro cuerpo para metabolizarlas con muy baja toxicidad hace que sean adecuadas en métodos poco invasivos para el diagnóstico y el tratamiento de enfermedades como el cáncer, donde ya se habían usado para el transporte selectivo de fármacos.
“Ahora hemos visto que las propias nanopartículas y las moléculas de las que se recubren para su uso biomédico pueden tener efectos antitumorales. Estas nanopartículas son como ‘nanocanicas sólidas’”, explica Domingo F. Barber, investigador del CSIC en el Centro Nacional de Biotecnología (CNB-CSIC) que ha liderado el trabajo.
“Tienen un núcleo compacto de óxido de hierro que hay que recubrir con diferentes materiales para proporcionar así más estabilidad y menos toxicidad. Nuestro grupo lleva años analizando diferentes tipos de recubrimiento y viendo cómo afectan a su entrada en la célula, su acumulación y degradación dentro de la misma, pero hasta ahora no habíamos estudiado su efecto en el metabolismo celular a nivel global”.
El investigador señala: “Sabíamos también que las nanopartículas pueden aumentar el estrés oxidativo celular sin afectar de manera considerable al equilibrio a determinadas dosis. Ahora nos preguntamos si algún tipo de recubrimiento podría potenciar aún más el estrés en células tumorales, donde la homeóstasis ya está desregulada, hasta niveles que conlleven la muerte celular de manera selectiva.”
Qué soluciones con nanopartículas de hierro se han analizado
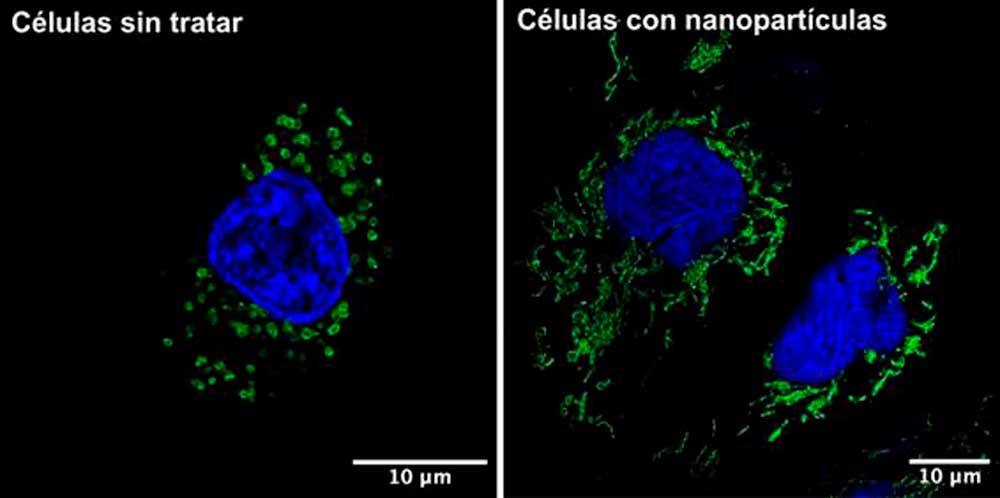
Neus Daviu, también investigadora del CNB-CSIC, detalla el análisis realizado: “Hemos utilizado tres tipos de recubrimientos diferentes en las nanopartículas y probado si afectan al metabolismo celular tanto en líneas celulares modelo de diferentes tipos de tumor (mama, páncreas y glioma) como en líneas no tumorales de macrófagos y células endoteliales que también se pueden encontrar en los tumores”.
Los parámetros estudiados son varios. Por un lado, la actividad metabólica de la célula, analizando el funcionamiento de las mitocondrias, el orgánulo encargado de la respiración. No solo cambian su forma, un síntoma claro de mal funcionamiento, sino que producen menos ATP (la molécula esencial para producir energía) y se degradan más, ya que la célula detecta que funciona mal y las elimina en un proceso llamado autofagia. Además, señala Daviu, “se produce una parada en el ciclo celular: las células tumorales tratadas con las nanopartículas cubiertas con DMSA (ácido dimercaptosucinico) crecen mucho menos, se quedan como ‘atascadas/atoradas’, un efecto muy deseado para frenar la proliferación de los tumores.”
Mejoran el resultado del tratamiento antitumoral
Los investigadores destacan el efecto diferencial en los distintos tipos celulares de tumor utilizados, siendo los más sensibles al efecto de estas nanopartículas los de origen mamario. Aunque estos datos se han obtenido en líneas celulares, otros trabajos de los mismos autores apuntan a un mejor funcionamiento in vivo (en ratones) de la terapia antitumoral cuando se administra a través de nanopartículas recubiertas con DMSA, lo que remarca su potencial para el transporte dirigido de fármacos y su colaboración en la reducción de los tumores.















