Un equipo de investigación de las universidades de Granada, Miguel Hernández de Elche, Zaragoza y el FISABIO ha establecido la relación existente entre dos proteínas sin relación aparente en el organismo. Una de ellas está sobreexpresada en células escamosas de cáncer de pulmón mientras que la otra participa en la respuesta inmune celular y en otros procesos oncológicos. El trabajo avanza así, en la búsqueda de dianas terapéuticas y de diagnóstico, mediante la descripción de sus interacciones en los tumores.
Un equipo de investigadores de las universidades de Granada, Miguel Hernández de Elche, Zaragoza y la Fundación para el Fomento de la Investigación Sanitaria y Biomédica de la Comunidad Valenciana (FISABIO) ha demostrado que existe una unión entre dos proteínas que, en principio, no tendrían que asociarse para ninguna función concreta en el organismo, durante el desarrollo de diferentes procesos tumorales. El trabajo muestra por primera vez cómo interactúan, mediante estudios computacionales y ensayos in vitro, y abre nuevas vías para conocer cómo se desarrolla, entre otros, el cáncer de pulmón.
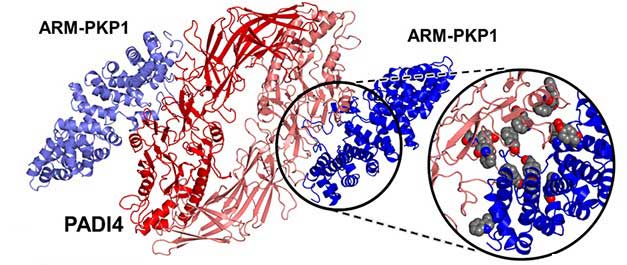
Los expertos ya conocían las características de estas proteínas, llamadas PADI4 y PKP1, por separado. Describieron sus propiedades, los lugares donde se encuentran y sus interacciones con otras moléculas. Ambas aparecen en procesos tumorales y se relacionan con otras macromoléculas con particularidades similares, por lo que decidieron unirlas para analizar su afinidad. En el artículo El dominio de repetición armadillo de Plakophilin 1 se une a la enzima humana PADI4 (‘The armadillo-repeat domain of Plakophilin 1 binds to human enzyme PADI4’ en inglés) publicado en la revista Biochim Biophys Acta – Proteins Proteom, muestran cómo se establece esta relación y qué papel juegan ambas en la proliferación de las células cancerosas. La investigación abre nuevas vías para entender la importancia de este tipo de uniones en el desarrollo de enfermedades y poder atacarlas.
PADI4 se encuentra normalmente en el núcleo celular donde se une a otras proteínas conocidas como ARM (con dominios de repetición armadillo). Esta estructura proteica es la que permite su paso al corazón de la célula. ARM-PKP1 tiene estos dominios. “El interés de la investigación radica en describir el interactoma de ARM-PKP y analizar in vitro la afinidad de sus relaciones. Es decir, es como si desplegamos las redes sociales de las proteínas en la célula para conocer todo sobre ellas”, indica a la Fundación Descubre la investigadora de la Universidad de Granada Esther Fárez Vidal, coautora del artículo.

Biofísica y Bioquímica
En trabajos anteriores, el grupo demostró que PADI4 altera las funciones de p53, un gen supresor del cáncer, promoviendo la proliferación de diversos tumores. También modifica algunos de los aminoácidos de otras proteínas, cambiando su estructura mediante un proceso llamado citrulinación.
Además, relacionaron a ARM-PKP1 con MYC, un conocido gen promotor de tumores, y propusieron a ARM-PKP1 como marcador para el diagnóstico del cáncer de pulmón. Asimismo, demostraron que forma parte de los desmosomas, que son los puntos de unión de las células entre sí con los que se crean los tejidos. Se podría decir que son el hilo con el que se cose el organismo. Por su parte, PADI4 puede añadir botones de un color u otro a ese traje mediante la citrulinación.
Con el estudio bioquímico de todas las proteínas y ácidos nucleicos que participan en el desarrollo de los distintos tipos de cáncer se pueden entender los cambios que se producen en el desarrollo de los tumores a nivel molecular. Estas modificaciones afectan a la función que realizan cuando la célula está sana.
Por otra parte, la biofísica permite conocer cómo se ordenan esos componentes químicos, cómo interactúan entre sí en cada compartimento celular o bajo una circunstancia concreta y describe la acción que realizan. De la misma manera que el hielo tiene unas propiedades diferentes al vapor de agua, la biofísica de las proteínas determina cómo actúan y con quién se relacionan según las condiciones de su entorno. “Nuestros hallazgos permiten profundizar en el conocimiento del desarrollo de tumores en los que se encuentran involucradas estas dos proteínas”, indica el investigador de la Universidad Miguel Hernández José Luis Neira.
Nuevas conexiones entre nuevos compañeros
Además de establecer por primera vez la relación existente entre ambas proteínas en el desarrollo de algunos tumores, el trabajo abre el camino para comprender la función y describir la formación de un mecanismo de defensa ante patógenos llamado trampas extracelulares de neutrófilos (NETs). Éstas están formadas por redes de fibras proteicas y ácidos nucleicos provenientes de los neutrófilos, las células que actúan como primera defensa ante una infección. Las NETs funcionan como si de un colador se tratara, creando una malla que tamiza y enreda a virus o bacterias.
Su construcción está modulada por PADI4 por lo que los expertos pensaron que ARM-PKP1 también podría intervenir en ellas. Así, el descubrimiento de la relación entre PADI4 y ARM-PKP1 puede ayudar a entender cómo funciona el sistema inmunitario. “Estos estudios, sugieren que PADI4 podría regular la función de ARM-PKP1, dificultando las interacciones con otras proteínas, lo que tiene gran importancia en varias enfermedades, incluido el cáncer”, señala la investigadora del FISABIO Camino de Juan.
Los expertos continúan sus investigaciones en este terreno con el objetivo de encontrar tratamientos que impidan el desarrollo de un tipo de tumor en concreto o alterar la formación de las NETs. “Si se confirma que la unión de ambas proteínas favorece el desarrollo de tumores, como parecen sugerir los resultados de este estudio, se podría impedir mediante el desarrollo de fármacos que se adhieran al menos a una de ellas en el mismo punto que usan para relacionarse”, concluyen los expertos.
La investigación se ha financiado mediante fondos del Programa de la Junta de Andalucía para el grupo ‘Genética Molecular’ de Granada, los proyectos ‘Diseño de nuevos antibióticos basados en un sistema de fosforilación exclusivo de bacterias’ y ‘Estructura energética y simulación de conformaciones parcialmente desplegadas de las proteínas hacia modelos atómicos cuantitativos de la estabilidad de las proteínas’ del Ministerio de Ciencia e Innovación. Además, participa el Fondo de Investigaciones Sanitarias del Instituto de Salud Carlos III, los grupos ‘Dianas proteicas y Compuestos Bioactivos’ y ‘Patología Digestiva’ que están financiados por la Diputación General de Aragón, la Comunidad Valenciana con un proyecto para Grupos consolidados (CIAICO/2021/135) y, por último, la Unión Europea mediante el programa ‘Invirtiendo en tu futuro’.
Texto y fotos: Fundación Descubre.