Las bacterias utilizan una estrategia para desplazarse que tiene cierto parecido con los motores eléctricos. Esta fórmula les vale para asegurar la movilidad de sus células hijas tras la división celular y su expansión, de ahí que el desentramado de esa maquinaria puede ser fundamental para combatir infecciones y optimizar el uso de bacterias beneficiosas en agricultura y biotecnología.

Un equipo de investigación del Centro Andaluz de Biología del Desarrollo (CABD) ha dado un paso más en la comprensión de la compleja maquinaria que permite a las bacterias desplazarse en su entorno. En un reciente estudio, liderado por el investigador del Área de Microbiología de la Universidad Pablo de Olavide Fernando Govantes y publicado recientemente en la revista Microbiological Research, el equipo ha desvelado los mecanismos moleculares que regulan el montaje y posicionamiento de los flagelos, unas diminutas estructuras en forma de hélice que funcionan como ‘motores eléctricos’ en estas células.
Cuál es el ‘motor eléctrico’ de las bacterias
El ‘motor eléctrico’ de las bacterias son los flagelos bacterianos, que los emplean para escapar de condiciones adversas y explorar nuevos hábitats. “Cada especie bacteriana presenta flagelos en un número y localización característico. La conocida Escherichia coli presenta flagelación peritrica, es decir, múltiples flagelos en toda su superficie. En estas bacterias, tras la división celular cada una de las células hijas hereda la mitad de los flagelos de la célula madre”, explica Fernando Govantes, investigador de la UPO y responsable del grupo ‘Genética del desarrollo de biofilms bacterianos’ del CABD, centro mixto del Consejo Superior de Investigaciones Científicas (CSIC), la Universidad Pablo de Olavide y la Junta de Andalucía.
“Otras bacterias, en cambio, presentan uno o varios flagelos en solo uno de sus polos”, añade el investigador, “por lo que en estas bacterias el reparto es imposible, así que una de las células hijas hereda el flagelo o los flagelos de la célula madre”. Entonces ¿cómo consiguen estas bacterias que las dos células hijas estén equipadas con los flagelos que le corresponden a su especie?
El trabajo del equipo del CABD ha estudiado este problema en la bacteria Pseudomonas putida, conocida por su capacidad de colonizar suelos y raíces de plantas y contribuir a la agricultura y la mejora de la calidad medioambiental. En su caso, los flagelos se agrupan en uno de los polos de la célula, formando un penacho de entre tres y seis unidades.
El hallazgo clave para entender el movimiento de las bacterias
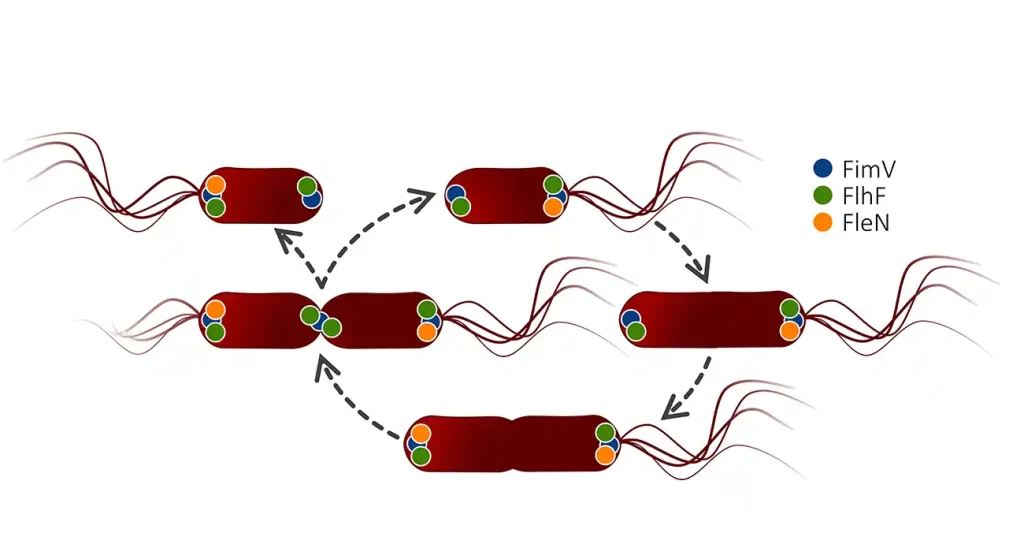
El estudio revela cómo Pseudomonas putida es capaz de fabricar nuevos flagelos en su polo ‘nuevo’ (creado tras la división celular) mientras conserva los flagelos heredados del polo ‘viejo’. Este proceso asegura que ambas células hijas tengan la capacidad de moverse, incluso en los casos en los que no heredan directamente los flagelos de la célula madre.
El trabajo identifica tres proteínas clave en este proceso: FleN, FlhF y FimV. Estas moléculas actúan como piezas fundamentales para determinar cuántos flagelos se fabrican, dónde se posicionan y cuándo se ensamblan. En particular, la proteína FimV funciona como un ‘faro molecular’, guiando la maquinaria de ensamblaje al lugar adecuado y asegurando que los nuevos flagelos emergen justo en el momento de la división celular, siendo esta nueva función de la proteína FimV uno de los hallazgos centrales de este estudio.
Según los investigadores, este mecanismo de regulación espacial, temporal y numérica es un ejemplo fascinante de precisión biológica, comparable al funcionamiento de un reloj molecular. “La capacidad de fabricar flagelos en el lugar y momento adecuados es esencial para la supervivencia de muchas bacterias. Este proceso, lejos de ser aleatorio, está finamente controlado a nivel molecular”, explica Marta Pulido-Sánchez, autora principal del estudio.
Importancia del hallazgo
El estudio no solo amplía nuestro conocimiento sobre cómo las bacterias logran desplazarse, sino que también tiene implicaciones más amplias para la biología molecular y la evolución. Respecto a la movilidad bacteriana y colonización de hábitats, hay que destacar que los flagelos permiten a las bacterias colonizar entornos complejos, incluyendo suelos agrícolas y organismos vivos. Comprender cómo se forma esta maquinaria podría abrir la puerta a nuevas estrategias para controlar bacterias patógenas o mejorar el rendimiento de bacterias beneficiosas en agricultura y biotecnología.
Por otro lado, el hallazgo también arroja luz sobre otro fenómeno, la generación de polaridad celular, que se refiere a la diferenciación entre los extremos de una célula. Este concepto, común en organismos complejos, tiene sus raíces en procesos como el observado en bacterias, lo que ayuda a comprender los orígenes evolutivos de estructuras y funciones celulares más avanzadas.
Próximos pasos en la investigación
El equipo de investigación planea profundizar en varias preguntas abiertas, relativas a la magnitud de los fenómenos de polaridad celular, a la sincronización del ensamblaje de los flagelos con el ciclo celular o a las diferencias moleculares explican que algunas bacterias fabriquen varios flagelos y otras solo uno.
Según los autores, pequeñas variaciones en las proteínas involucradas podrían ser responsables de la diversidad de patrones de flagelación observados en la naturaleza. Esto plantea nuevas preguntas sobre la relación entre la estructura de los flagelos, el hábitat y el estilo de vida de cada bacteria.